硕士论文网第2021-03-23期,本期硕士论文写作指导老师为大家分享一篇
西药学论文文章《关于新型冠状病毒mRNA疫苗临床前 药学研发和评价的思考》,供大家在写论文时进行参考。
新型冠状病毒(SARS-CoV-2)于 2019 年 12 月初在我国被发现,呈现出高传染性及快速传播的特点,并可导致一定比例患者出现重症新型冠状病毒肺炎(COVID-19)。SARS-CoV-2 是一种与重症急性呼吸道综合症冠状病毒(SARS-CoV)关系密切的新型人类冠状病毒[1-2],已在世界范围内传播并引发了全球性公共卫生危机。SARS-CoV-2 引起的临床表现包括无症状感染、轻度流感样症状、肺炎、严重急性呼吸窘迫综合征甚至死亡[3-4]。COVID-19 是一种新型人类疾病,尚无有效的治疗方法,且 SARSCoV-2 的保护性免疫程序目前仍尚不清楚,存在康复患者再次感染的可能性[5-7]。因此,研制安全有效的 COVID-19 疫苗是防治 SARS-CoV-2 的有效手段之一。自 COVID-19 疫情发生以来,我国疫苗研发及生产企业总体上采用灭活疫苗、重组蛋白疫苗、载体疫苗、减毒活疫苗、核酸疫苗共 5 条技术路线进行疫苗研发。mRNA 疫苗作为核酸类疫苗,凭借其自身特点,内外多家企业正积极进行研发及申报。本文结合近年来国内外 mRNA 疫苗的发展趋势及申报现状,对 SARS-CoV-2 mRNA 疫苗的技术特点进行分析,结合审评实践,着重就临床前药学研发和评价的一般考虑及评价要点展开探讨,以期促进此类药物由研发顺利转入早期临床试验阶段,并加强药物研发的风险控制。
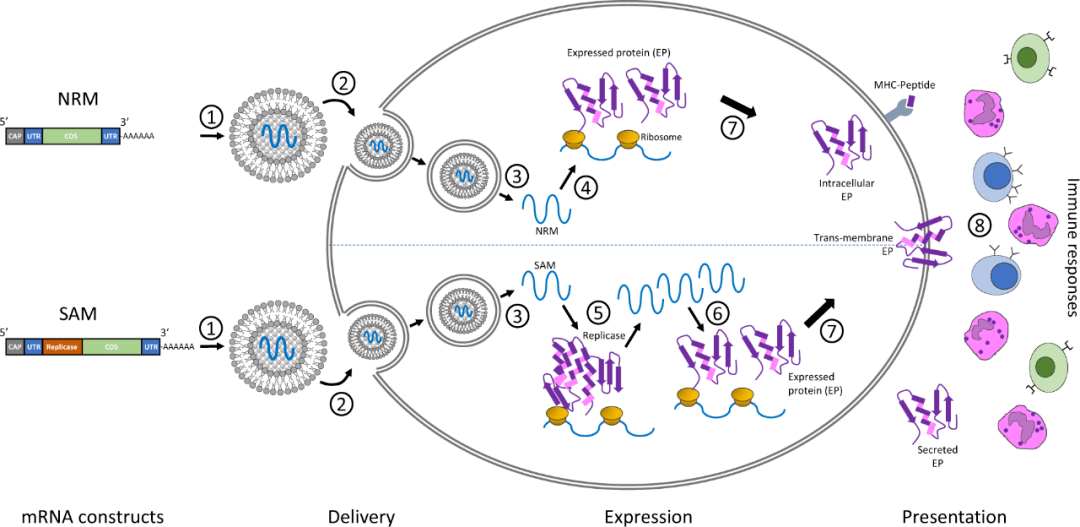
Jacob 和 Monod 在 1961 年提出 mRNA 的概念,1990 年 WOLFF 等[8]证明,将体外转录(in vitro transcribed IVT)mRNA 或质粒 DNA 直接注射至小鼠骨骼肌,可在注射的肌肉中表达其编码蛋白。1995 年CONRY 等[9]首次将 mRNA 作为疫苗进行免疫测试。20 世纪 90 年代,进行了 mRNA 疫苗多种临床前应用探索,包括癌症 mRNA 疫苗、传染病 mRNA 疫苗等[10-14]。随着 RNA 生物学、化学、稳定性和递送系统方面的技术进步,克服了直接人体注射 mRNA 免疫效果差、半衰期短的一系列障碍,加速了 mRNA疫苗的发展[15-16]。核酸疫苗包括 DNA 疫苗和 mRNA 疫苗[ 15 ],mRNA 疫苗与其他核酸疫苗理论上的主要区别包括:mRNA 一旦到达细胞质就会立即翻译,不需进入细胞核即可发挥功能;mRNA 不会整合至基因组中,不会造成插入突变的风险;多数药物应用表明,mRNA 疫苗中 mRNA 瞬时表达仅有短暂活性,通过人体的自然机制代谢和消除,因此被认为是安全的;mRNA 的生产相对简单、成本较低[16-17]。阳离子聚合物和脂类具有将遗传物质转运进入细胞的能力,将其制成纳米颗粒转运 mRNA,并进行了广泛的研究,结果表明,纳米颗粒载体具有能穿过生物屏障、提高生物相容性和延长循环时间等优点,能有效地将核酸传递至靶细胞,提高了核酸类药物疾病治疗的成功率,加速了 mRNA 疫苗的发展。纳米颗粒载体对 mRNA 药物的转运效率很大程度上取决于其逃逸溶酶体的能力,即纳米颗粒载体进入细胞后,经膜泡包被并传递进入溶酶体,保护包裹mRNA 免受溶酶体降解及破坏,从溶酶体成功逃离至细胞质发挥药效[18-19]。香港大学袁国勇团队报告了 COVID-19 康复患者发生再次感染的第 1 例病例,研究表明,尽管由于自然感染或接种疫苗产生了群体免疫力,但 SARSCoV-2 可能持续在人群中传播。对再次感染患者的进一步研究将阐明对 SARS-CoV-2 免疫保护的重要因素,对疫苗的设计、研发具有重要意义[6]。综上所述,mRNA 疫苗人体免疫的过程一定程度上模仿了病毒入侵过程,能激发人体细胞免疫和体液免疫反应。对于 mRNA 疫苗的开发及质量研究,在满足常规纳米制剂药物的关键质量属性(CriticalQuality Attribute,CQA)前提下,还应重点关注以下质量研究的相关方面:制剂电荷(Zeta 电位)不仅影响纳米颗粒的稳定性,还会影响纳米制剂的入胞、内体逃逸以及不良反应;mRNA 疫苗在生产过程中、终产品、稳定性研究等不同阶段纳米颗粒粒径分布的变化;制剂中阳离子聚合物及脂质成分的选择是为包裹 mRNA 以达到相应药效,因此制剂的 pH、脂质成分的化学结构、RNA 包封率等,均会影响制剂成分与 mRNA 复合形成纳米颗粒的稳定性、体内药物释放、药效等;mRNA 纳米颗粒在体内外表达及免疫原性相关研究,是非临床质量研究中对药物有效性、安全性研究的重要技术支持。上述药品 CQA 不仅是mRNA 疫苗在人体内发挥作用机制的关键影响因素,也是药品研发及质量研究的关注点。
在 COVID-19 疫情爆发以前,mRNA 疫苗已在预防性疫苗和治疗性肿瘤疫苗领域开展了多个临床研究,其中进展最快的尚在Ⅱ期临床试验阶段[20-23]。自 COVID-19 疫情发生以来,国内外多家企业正积极研发、申报 SARS-CoV-2 mRNA 疫苗。国外已有两家企业对 SARS-CoV-2 mRNA 疫苗的临床试验情况进行了相关报道。Moderna 公司候选疫苗 mRNA-1273,采用脂质纳米颗粒包裹经核酸修饰的 SARSCoV-2 Spike 糖蛋白,Ⅰ期临床试验显示,间隔 28 d2 次免疫后,抗体随接种剂量及次数增高,不良事件包括疲劳、寒战、头痛、肌痛和注射部位疼痛[24 ];BioNtech 公司候选疫苗 BNT162b1,采用脂质纳米颗粒包裹 SARS-CoV-2 三聚化 Spike 糖蛋白受体结合区域(receptor-binding domain,RBD),Ⅰ/ Ⅱ期临床中期试验显示,间隔 21 d 2 次免疫后,血清中RBD 结合 IgG 浓度和 SARS-CoV-2 综合抗体滴度随接种剂量及次数增高,几何平均综合效价达到 COVID-19 恢复期人血清的 1. 8 ~ 2. 8 倍,局部及全身不良反应呈剂量依赖性,一般是轻度到中度,并且是短暂的[17]。国内军科院联合苏州艾博公司申报的 SARSCoV-2 mRNA 疫苗 ARCov 已获批进入临床试验,目前尚无相关临床试验数据的报道。临床前研究表明,候选疫苗 ARCoV 采用脂质纳米颗粒包裹 SARSCoV-2 RBD,经肌肉免疫小鼠和非人灵长类动物,可诱导 SARS-CoV-2 中和抗体及偏向 Th1 的细胞免疫反应。在小鼠中接种 2 剂 ARCoV 可完全保护小鼠免受 SARS-CoV-2 小鼠适应株病毒的攻击。ARCoV以液体配方制备,可在室温下储存至少 1 周,目前正处于一期临床试验阶段[25]。3 SARS-CoV-2 mRNA 疫苗申报临床药学研究一般原则及评价思考SARS-CoV-2 mRNA 疫苗研发总体工艺路线为选取 SARS-CoV-2 蛋白,制备体外转录 mRNA,研发制剂组成、开发制剂工艺、以 mRNA 原液制备纳米颗粒,获得终产品。
目前全球范围内尚无 mRNA 疫苗批准上市,对该类疫苗用于人体的安全性和有效性尚在探索中。同时,mRNA 疫苗创新程度较高,制剂工艺及成分相对复杂,综合考虑疫苗应用于健康人群,对其质量和安全性也提出了较高的要求。对于 SARS-CoV-2mRNA 疫苗的开发和药学技术审评,基本理念应满足疫苗产品的常规要求,此外,还应结合本品 mRNA分子结构、制剂处方组成、作用机制的新特点以及不同于以往疫苗的生产工艺、质量控制等方面,进行相应的研究。下面拟结合具体药学评价实践,对相关技术审评思考进一步阐述。工艺开发阶段,应进行各步工艺参数对 mRNA 和 / 或制剂质量特性影响的研究;研发阶段应通过工艺参数的研究和优化,确立mRNA 和 / 或制剂的生产工艺及工艺过程控制策略。临床样品制备工艺应具备一定规模,并且还应具有一定的生产连续性和放大可行性,临床样品应在符合 GMP 的条件下生产。产品开发进程中应不断积累数据,持续确认工艺的一致性和可控程度。mRNA 原液生产工艺应关注生产工艺设置的合理性,对生产工艺开发及确定提供研究资料,原液生产工艺优化应提高产品纯度及质量。mRNA 原液质量研究应关注 mRNA 序列完整性、加帽率、去磷酸化、Poly A 尾长度、纯度、mRNA 序列生物活性表达、工艺相关杂质的去除、产品相关杂质残留等相关方面。mRNA 疫苗纳米颗粒生产工艺设备的选用应考察现有制剂规模、放大能力、耗材使用次数、GMP符合情况等。纳米颗粒质量研究应关注包封率、粒径分布、纳米粒的稳定性、纯度、不完整 LNP、纳米颗粒各成分含量、工艺相关杂质的去除、免疫原性等相关方面。 鉴于 mRNA 递送系统的复杂性及可能存在的佐剂作用,结合国内外在研 mRNA 递送平台的实际情况,目前不建议添加单独的佐剂成分。如果需要添加佐剂,应保证添加的佐剂不会引起不可接受的毒性。临床前须通过明确的功能指标及试验研究证实佐剂发挥的具体的免疫调节作用,同时关注添加该佐剂成分后可能引入的风险,如对 mRNA结构、非预期免疫反应及免疫损伤和免疫病理等。使用佐剂所带来的增强免疫应答的潜在获益必须超过其所带来的风险等。应参照佐剂相关研究指南提交全套的佐剂药学研究资料。
SARS-CoV-2 mRNA 疫苗为新生事物,纳米颗粒制剂组成及制备较为复杂,相应研发候选疫苗均处于研发早期,细胞水平表达活性、体内效力等综合质控指标较为重要,在研发过程中需积累相关数据。SARS-CoV-2 自流行以来,我国已采取强有力的防控措施,并较好地控制了 COVID-19 在我国的流行,但世界范围内 COVID-19 的流行传播仍未得到有效控制。目前尚无有效治疗 COVID-19 的方法,疫苗的开发及应用对于 COVID-19 的防治尤为重要。目前全球范围内尚无 mRNA 疫苗批准上市,对该类疫苗用于人体的安全性和有效性尚在探索中。结合 SARS-CoV-2 mRNA 疫苗国内外申报情况及相关临床试验,对于这种新型疫苗开发模式,药学研究应充分考虑其作为“创新药”的研发规律及技术特点,在保证临床用药足够安全、有效和质量可控性的前提下,应对其进行充分的风险获益评估,以评价其是否可进入人体临床试验。相信在工业界创新驱动、技术研发不断积累、对 mRNA 疫苗药学研究不断深入的情况下,以及与监管风险管控的互动推进下,未来将不断有 SARS-CoV-2 mRNA 疫苗获批进入临床试验以验证其对人体的安全性和有效性。
参考文献
[1] CHEN N,ZHOU M,DONG X,et al. Epidemiological andclinical characteristics of 99 cases of 2019 novel coronaviruspneumonia in Wuhan,China:a descriptive study[J]. The Lancet,2020,395(10223):507-513.
[2] FAN W,SU Z,BIN Y,et al. Author correction:A new coronavirus associated with human respiratory disease in China[J]. Nature,2020,580(7803):E7.
[3] HUANG C,WANG Y,LI X,et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan,China[J]. The Lancet,2020,395(10223):497-506.
该论文为收费论文,请扫描二维码添加客服人员购买全文。

以上论文内容是由
硕士论文网为您提供的关于《关于新型冠状病毒mRNA疫苗临床前 药学研发和评价的思考》的内容,如需查看更多硕士毕业论文范文,查找硕士论文、博士论文、研究生论文参考资料,欢迎访问硕士论文网西药学论文栏目。

